Синтетические компартменты блокируют совместное использование генов устойчивости к антибиотикам
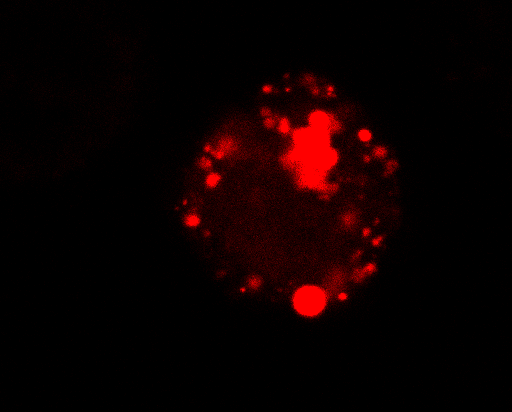
Биомедицинские инженеры из Университета Дьюка продемонстрировали новый синтетический подход к управлению биохимическими процессами в клетках. Вместо того чтобы создавать частицы или структуры, которые непосредственно взаимодействуют с клеточными механизмами через традиционные механизмы "замка и ключа", клетки направляются на создание отсеков, которые физически останавливают - или стимулируют - биомолекулярные функции.
Исследователи продемонстрировали, что их подход может влиять на два клеточных процесса, один из которых отвечает за распространение генетических инструкций среди бактерий, а другой - за модуляцию белковых цепей в клетках млекопитающих. Полученные результаты могут оказаться бесценными для разработки новых стратегий понимания и борьбы с болезнями или для остановки распространения устойчивых к антибиотикам патогенов.
Результаты исследования опубликованы 6 февраля в журнале Nature Chemical Biology.
"Живая клетка похожа на густой суп с лапшой, плотность биомолекул в клетке иногда описывается так, как будто каждый человек на планете помещается в Большое соленое озеро", - говорит Ифань Дай, постдокторский исследователь, работающий в лаборатории Ашутоша Чилкоти, заслуженного профессора биомедицинской инженерии Алана Л. Каганова, и лаборатории Лингчонга Ю, заслуженного профессора биомедицинской инженерии Джеймса Л. Мериама в Дьюке.
"Янтарное образование иногда запирает и сохраняет животных на тысячи лет благодаря своим отличительным свойствам материала по сравнению с окружающей средой", - сказал Дай. "Ученые подумали, что, возможно, клетки могут делать то же самое с информацией".
"Образование янтаря иногда запирает и сохраняет животных на тысячи лет из-за его отличительных свойств материала по сравнению с окружающей средой. Ученые подумали, что, возможно, клетки могут делать то же самое с информацией".
Ифань Дай
Биологическая микромашина обычно опирается на так называемые механизмы "замка и ключа", когда белок, генетическая нить или другая биомолекула имеет правильную форму и размер для взаимодействия со своей целевой структурой. Поскольку это самые простые и очевидные процессы для изучения и воссоздания, почти все биомедицинские исследования были сосредоточены на огромной, сложной сети механизмов.
Но поскольку клетки так плотно упакованы этим биомолекулярным механизмом, и им необходимо контролировать активность, чтобы отвечать на различные потребности в течение всей жизни, ученые давно подозревали, что у них должны быть способы регулировки активности. Но только в 2009 году исследователи обнаружили механизм одного из таких способов, который называется биологическими конденсатами, опосредованными фазовым разделением.
Биологические конденсаты - это небольшие отсеки, которые клетки могут создавать, чтобы либо разделять, либо удерживать вместе определенные белки и молекулы, препятствуя или способствуя их активности. Исследователи только начинают понимать, как работают конденсаты и для чего они могут быть использованы. Создание платформы, позволяющей клеткам создавать синтетические версии этих биомолекулярных клеток, является большим шагом на пути к достижению обеих целей.
"Для меня самым замечательным является эффективность правил, выработанных в ходе прошлых исследований, в руководстве рациональной инженерией физических свойств этих конденсатов, которые, в свою очередь, эффективно работают в живых клетках, несмотря на множество сбивающих с толку факторов, связанных с внутриклеточной средой", - сказал Ты.
Эти синтетические конденсаты можно включать внутри клетки, чтобы управлять ее функционированием". Эта работа является частью развивающейся области, которая позволит нам перепрограммировать жизнь новыми и захватывающими способами".
Ашутош Чилкоти
В статье Дай, Чилкоти, Ты и их коллеги из лаборатории Рохита В. Паппу, заслуженного профессора биомедицинской инженерии Джина К. Бира и директора Центра биомолекулярных конденсатов при Вашингтонском университете в Сент-Луисе, демонстрируют создание синтетического набора генетических инструкций, которые заставляют клетки создавать различные типы конденсатов, удерживающих различные биомолекулярные процессы. В одном из примеров они создают конденсаты, которые не позволяют маленьким пакетам ДНК, называемым плазмидами, перемещаться между бактериями в процессе, называемом горизонтальным переносом генов. Этот процесс является одним из основных методов, используемых патогенами для распространения устойчивости к антибиотикам, и его остановка может стать ключевым шагом в борьбе с созданием и распространением "супержуков".
Исследователи также показали, что могут использовать этот подход для управления транскрипцией ДНК в РНК в E. coli, эффективно усиливая экспрессию определенного гена путем объединения различных факторов. Далее они демонстрируют этот подход для модуляции белковых цепей в клетках млекопитающих. Модулирование активности конкретных генов и белковой активности может стать полезным способом борьбы с широким спектром заболеваний, особенно генетических.
"Эта работа показывает, что мы, биомедицинские инженеры, можем разрабатывать новые молекулярные части с нуля, убеждать клетку производить их и собирать эти части внутри клетки, чтобы создать новую машину", - сказал Чилкоти. Затем эти синтетические конденсаты можно включать внутри клетки, чтобы контролировать ее функционирование". Эта работа является частью развивающейся области, которая позволит нам перепрограммировать жизнь новыми и захватывающими способами".
Это исследование было поддержано Управлением научных исследований ВВС (FA9550-20-1-0241) и Национальными институтами здравоохранения (MIRA R35GM127042 и R01EB031869).
ЦИТАТА: "Программируемые синтетические биомолекулярные конденсаты для управления клетками", Ифань Дай, Мина Фараг, Донгхон Ли, Сянцзе Цзэн, Киери Ким, Хе-ин Сон, Сяо Гуо, Джонатон Су, Нихил Петерсон, Джавид Мохаммад, Макс Ней, Дэниел Марк Шапиро, Рохит В. Паппу, Ашутош Чилкоти, Лингчонг Ты. Nature Chemical Biology, 6 февраля 2023 года. DOI: 10.1038/s41589-022-01252-8
*** Переведено с помощью www.DeepL.com/Translator (бесплатная версия) ***

спасибо,не знал об этом)