Альтернатива антибиотикам, вырабатываемым бактериями кишечной микробиоты
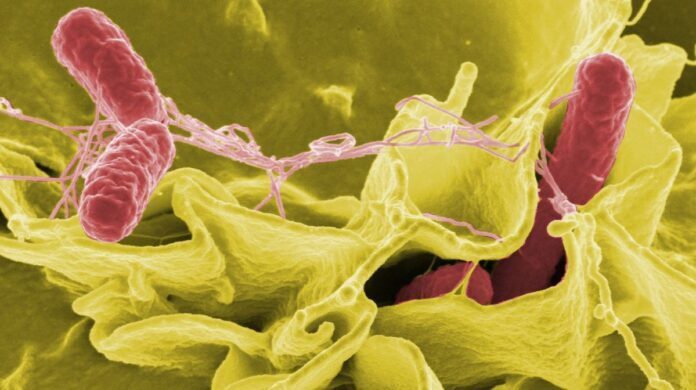
Бактерии, естественным образом присутствующие в нашем кишечнике, по-видимому, производят вещества, способные ингибировать рост и вирулентность некоторых сальмонелл. Выявление этих соединений может проложить путь к разработке альтернативы антибиотикам.
Сальмонеллез — это, как правило, инфекция пищевого происхождения, вызывающая боль в животе, диарею, тошноту и иногда сильную рвоту. Это вызвано бактериями из семейства сальмонелл, которым удается преодолеть кишечный барьер. Среди них Salmonella Heidelberg (S. Heidelberg) отличается тем, что проявляет устойчивость ко многим антибиотикам, так что альтернативы последним могут быть полезны при лечении инфицированных пациентов. Одним из предполагаемых путей является использование пробиотиков: эти бактерии, полезные для нашего здоровья, действительно производят метаболиты, которые могут бороться с некоторыми кишечными патогенами. В Numecan Institute в Ренне Латифа Бусаргин и ее команда изучали свойства Bacteroides fragilis. (B. хрупкая) , бактерия из семейства Bacteroidota, наиболее распространенная в кишечнике, которая помогает поддерживать баланс микробиоты. В предыдущих исследованиях мы показали, что присутствие B.fraxly снижает способность S.Heidelberg преодолевать кишечный барьер у мышей. Мы продолжили эту работу, чтобы понять механизмы, ответственные за эти свойства. — говорит исследователь. В сотрудничестве с Софи Томаси из Реннского института химических наук (CNRS, подразделение 6226) она работала над идентификацией и характеристикой соединений, выделяемых B. хрупким, которые лежат в основе наблюдаемого противоинфекционного эффекта.
От смеси соединений к активным молекулам
Эта работа проводится с культурой B. хрупких в лаборатории, а точнее с их культуральным супернатантом - жидкой средой, в которой бактерии размножаются in vitro и где мы находим метаболиты, которые они выделяют в окружающей среде. Учитывая богатство этого супернатанта, его сначала фракционировали, чтобы отделить соединения, близкие с физико-химической точки зрения. Таким образом, было собрано шесть различных фракций, которые затем по отдельности привели в контакт с С. Гейдельбергом. Два из них смогли ингибировать рост патогенных бактерий. При введении инфицированным мышам эти же фракции снижали воспалительную реакцию на уровне кишечника и снижали способность возбудителя проникать через кишечный барьер.
Затем была начата работа по идентификации биологически активных соединений. Два из них было легко распознать, потому что они естественным образом присутствуют в желчных соках, вырабатываемых печенью: холевая кислота и дезоксихолевая кислота. Мы уже знаем, что эти две желчные кислоты, взятые по отдельности, не обладают доказанным антибактериальным действием. В естественных условиях. Им, вероятно, нужны биологические кофакторы, чтобы быть активными против S. Heidelberg», — объясняет Латифа Бусаргин. Поэтому исследователь продолжает химический анализ, чтобы выяснить природу других потенциально активных молекул. «Затем мы проверим каждое из идентифицированных соединений по отдельности или в небольшом количестве, чтобы определить, какие из них представляют интерес. »
Трек для нескольких клинических разработок
Другие продолжающиеся эксперименты направлены на определение того, активны ли эти метаболиты в отношении других видов бактерий, патогенных для человека или животных. Наконец, « анализы, проведенные на мышах, показали, что те же самые фракции супернатанта оказывают влияние на бактерии кишечной микробиоты, которые, как известно, связаны с такими заболеваниями, как тревога или депрессия…» . Эти результаты открывают путь для дальнейшей работы в этом направлении.
« Антибиотики напрямую блокируют определенные важные пути бактериального метаболизма, но создаваемый ими стресс таков, что способствует развитию устойчивости к этим антибиотикам, — вспоминает исследователь. Подход пробиотик отличается.B. хрупкий или его метаболиты атакуют не бактерию, а то, как она взаимодействует с клетками хозяина. Это позволяет более тонко регулировать его вирулентность и, вероятно, снижает риск развития резистентности. С помощью Inserm Transfert его команда оформила патент на использование B. хрупкого. Для борьбы с некоторыми бактериальными инфекциями: подход, который позволит предусмотреть клиническую разработку этого подхода, когда доклинические данные оправдают его.
Латифа Бусаргин — преподаватель Реннского университета и исследователь в отделении метаболизма питания и рака (Numecan, подразделение 1317 Inserm /INRAE/Университет Ренна, Ренн, Франция).


