Метаболизм отвечает сигналам для точной настройки роста клеток
Клетки используют различные метаболические пути для синтеза строительных блоков для роста и пролиферации. Чтобы обеспечить сбалансированный рост, эти процессы биосинтеза должны быть строго скоординированы. Исследователи из Института биологии старения имени Макса Планка вместе с командой национальных и международных сотрудников теперь определили молекулярный механизм, который определяет способность клетки вырабатывать липиды, чтобы затем соответствующим образом блокировать или активировать все другие процессы биосинтеза, такие как синтез белка.
Клетки накапливают массу и растут, используя питательные вещества и энергию для построения мембран, белков, нуклеиновых кислот и других макромолекулярных структур, благодаря скоординированному действию различных метаболических путей. Таким образом, механизмы восприятия питательных веществ гарантируют, что клетки растут только при оптимальных условиях.
Наиболее важным датчиком питательных веществ в клетках является белковый комплекс, называемый mTORC1. Когда аминокислот, строительных блоков белков, много, mTORC1 активен и способствует синтезу белка, таким образом связывая доступность аминокислот с соответствующей клеточной функцией. Однако, как определяется способность клеток вырабатывать липиды и играет ли mTORC1 роль в этом процессе, очень плохо изучено.
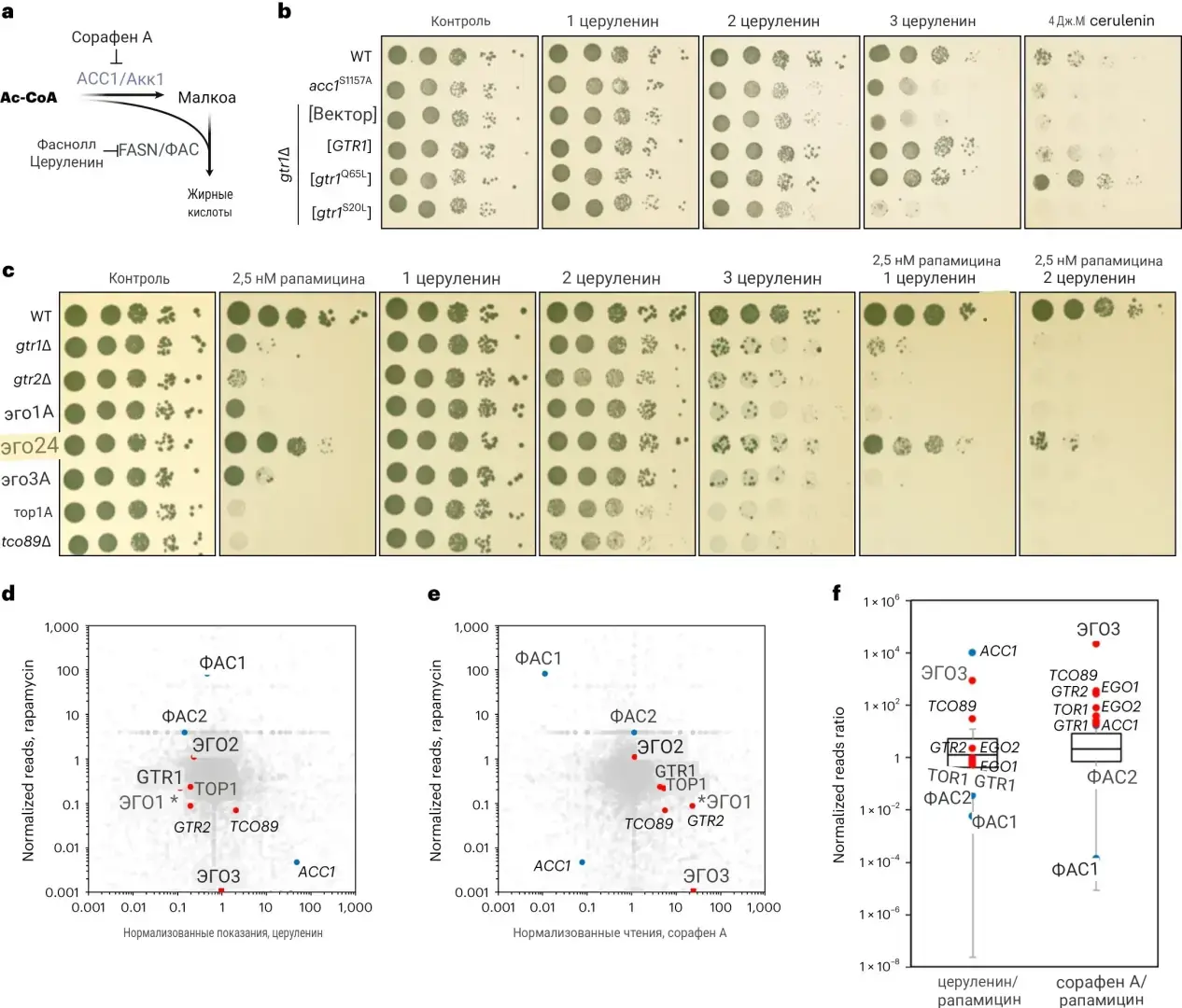
При биосинтезе жирных кислот ацетил-КоА, метаболит, образующийся в основном при расщеплении глюкозы (другого важного питательного вещества), сначала превращается в малонил-КоА с помощью фермента под названием ACC1, который затем превращается в жирные кислоты с помощью фермента под названием FASN (синтаза жирных кислот).
Исследователи показали, что накопление малонил-КоА, которое может происходить при низких уровнях или активности FASN, приводит к ингибированию активности mTORC1 и снижению других биосинтетических функций, которые регулируются mTORC1, таких как синтез белка. Удивительно, но они обнаружили, что малонил-КоА связывается непосредственно с каталитическим карманом mTOR, вытесняя АТФ, другой метаболит, который необходим для активности mTOR и фосфорилирования его субстратов.
"Эти результаты подчеркивают, что малонил-КоА является первым описанным эндогенным метаболитом, который действует как АТФ-конкурентный ингибитор сигнальной киназы в клетках млекопитающих", - говорит Константинос Деметриадес, руководитель исследовательской группы в Институте биологии старения Макса Планка и руководитель исследования.
"Примечательно, что это явление эволюционно сохраняется от дрожжей до клеток человека, таким образом, оно представляет собой древний механизм, с помощью которого липидный обмен взаимодействует с основным регулятором всех других метаболических процессов, mTORC1".
Связь биосинтеза жирных кислот с ростом клеток через mTORC1
На молекулярном уровне исследователи обнаружили, что mTORC1 формирует физические взаимодействия с ACC1 и FASN, что позволяет ему напрямую определять уровни малонил-КоА в месте, где вырабатывается метаболит. Таким образом, прямое связывание малонил-КоА с mTORC1 отключает все другие клеточные процессы, которые контролируются ниже по течению этого комплекса.
В результате, в условиях, когда клетка не может вырабатывать достаточное количество жирных кислот, ингибирование mTORC1 также блокирует синтез белков, другие анаболические процессы и, в конечном счете, рост клеток, пока условия снова не станут оптимальными.
Поскольку фармакологические ингибиторы FASN, подобные тем, что использовались в этом исследовании, используются в клинике в качестве противораковых препаратов, эти открытия также могут иметь значение для лечения рака в будущем. Основываясь на описанных здесь данных, ингибиторы FASN, вероятно, оказывают двоякое действие на раковые клетки: они не только блокируют синтез жирных кислот, который необходим для формирования мембран и выработки энергии, но также ингибируют активность mTORC1, которая не регулируется при большинстве видов рака.

